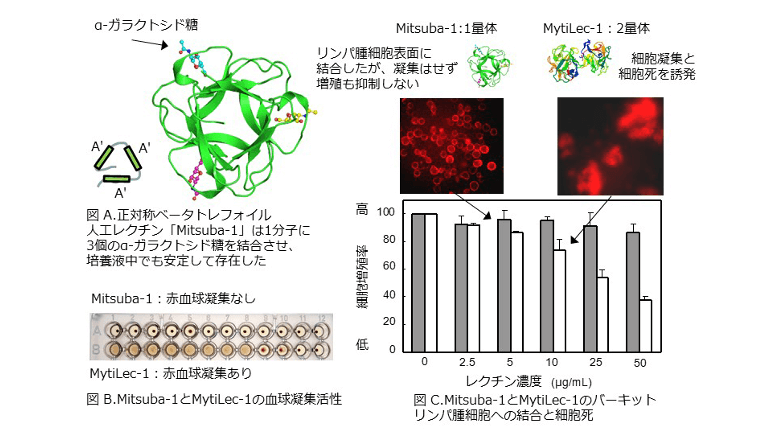
ムール貝(ムラサキイガイ)のレクチン、MytiLec(マイティレック)-1は、α-ガラクトース糖を末端に持つグロボトリオース(Gb3)糖鎖と結合する。Gb3糖鎖を多く持つヒト・バーキットリンパ腫の培養細胞にこれを加えると、Gb3と結合し、細胞内部のタンパク質が活性化されて細胞死が起きる。MytiLec-1の立体構造は、ベータ トレフォイル(三つ葉)構造で、抗腫瘍細胞活性の発揮とタンパク質としての安定性の保持には、2量体化を要する。
赤血球凝集活性を持つため、そのままでは使えない。培養液中の安定性と抗腫瘍性は残しつつ赤血球凝集活性を除く加工を――
と、横浜市立大学大学院 生命医科学研究科 寺田大樹博士、ジェレミー・テイム教授、生命ナノシステム科学研究科 大関泰裕教授と、理化学研究所 ライフサイエンス技術基盤研究センター 構造バイオインフォマティクス研究チームのケム・ツァン チームリーダー、長崎国際大学大学院 薬学研究科 藤井佑樹講師らの共同研究グループは、計算機科学を用いて設計した、人工レクチンMitsuba(ミツバ)-1の作出に成功した。
既知の2000以上のべータ トレフォイル構造を計算機で解析し、溶液中での安定性に富む正対称形の骨格を選択。そしてMytiLec-1のポリペプチド鎖内に3か所ある糖鎖結合サブドメイン(A-B-C)のうち、糖鎖結合性の最も強いAサブドメインを鋳型とし、そのアミノ酸を40%改変したA'-A'-A'型の「Mitsuba-1」を設計。Mitsuba-1タンパク質は大腸菌に合成させて作り出した。
人工のMitsuba-1もベータ トレフォイル構造を有す。その立体構造(PDB ID = 5XG5)は、3か所ある糖鎖結合部位の全てにGb3糖鎖の末端にあるɑ-ガラクトシド糖が結合することを、X線結晶解析から証明した。Mitsuba-1は天然MytiLec-1の2量体化に必要なアミノ酸配列を欠き、単量体として存在。これをバーキットリンパ腫細胞に加えたところ、細胞死は引き起こさなかったが、表面のGb3糖鎖を介して細胞に結合した。そして、レクチンの創薬上の課題である赤血球細胞の凝集は起こさず、単量体として設計したMytiLec-1に比べても、培養液中の可溶性など、タンパク質の安定性の点で各段に優れていたことが判明した。
薬剤やタンパク質と複合体化させた新素材として、糖鎖を標的にしたがん治療薬開発への応用が期待される。人工レクチンの研究成果は、「Scientific Reports」に掲載された。
