一方で、それを続けることにより、副作用の起こりうることが問題視されている。
化学療法を継続することで、筋力低下による疲労感、倦怠感や廃用(寝たきり)症候群、心筋症といった容体が現れる可能性は知られている。しかし、抗がん剤が筋力低下を起こす原因についてはよくわかっていなかったという。
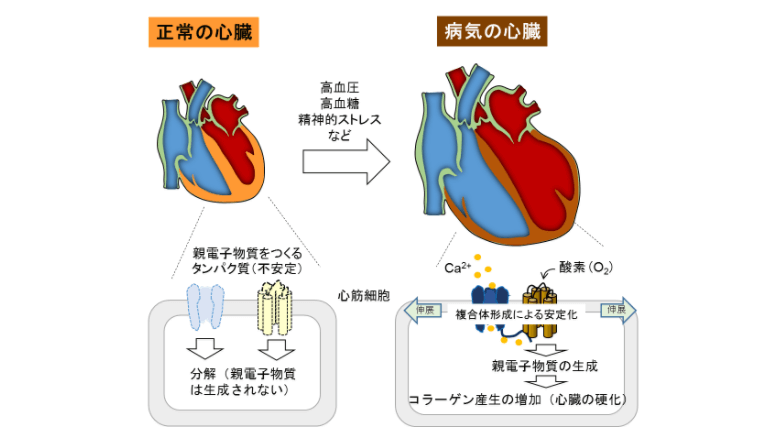
生理学研究所の西田基宏教授(九州大学教授兼務)は、九州大学、群馬大学、東京大学、京都大学との共同研究において、心筋細胞膜に存在し、抗がん剤投与により発現増加するCa2+透過型カチオン(TRPC3)チャネルが、活性酸素を発生することで心筋細胞を萎縮することを発見。同チャネルを阻害する化合物が、抗がん剤誘発性の心不全を軽減することを明らかにした。
研究グループは昨年、TRPC3が細胞膜タンパク質NADPHオキシダーゼ2(Nox2)と相互作用し、Nox2タンパク質の分解を抑制(安定化に寄与)していることを報告――。そして今回、高用量のアントラサイクリン系抗がん剤ドキソルビシンが、心臓において急性期にTRPC3-Nox2タンパク複合体数を増加し、酸化ストレスを誘発することで心筋細胞を萎縮させることを、マウスを用いて証明した。
ドキソルビシン投与は、心筋細胞の「低酸素化」を誘発することでTRPC3タンパク質の発現を増加し、TRPC3がNox2タンパク質を安定化することでNox2依存的な活性酸素の生成を促し、結果的に心筋細胞を萎縮させることがわかった。そこで特異的に、TRPC3とNox2の相互作用を阻害するタンパク質をマウスの心筋細胞に発現させたところ、ドキソルビシン投与によるマウスの心筋萎縮と心機能低下が軽減された。さらに、TRPC3チャネルを阻害する複数の化合物の中から、TRPC3-Nox2複合体形成も抑制できる化合物pyrazole-3を同定。これがドキソルビシン誘発性の心筋萎縮を顕著に抑制した。
一方、過去に報告されている、適度な運動がモデルマウスのドキソルビシン心毒性を軽減することについて、TRPC3遺伝子欠損マウスの心機能を解析した結果、アスリートモデルマウスの心臓と同様にコンプライアンス(弾性と伸展性)の高い柔軟な心筋を呈していることがわかった。
TRPC3チャネル活性だけを変化させても心筋の柔軟性は変化しないことから、TRPC3-Nox2複合体形成の阻害が、適度な運動を模倣することで、抗がん剤投与による急性期の心筋萎縮を抑制する可能性が示されたという。
研究結果は本日、米国医学誌が発行する「JCI insight」(電子版)に掲載された。
